Приложение
Как установить приложение на iOS
Смотрите видео ниже, чтобы узнать, как установить наш сайт в качестве веб-приложения на домашнем экране.
Примечание: Эта возможность может быть недоступна в некоторых браузерах.
-
Уважаемый посетитель!!!
Если Вы уже являетесь зарегистрированным участником проекта "миХей.ру - дискусcионный клуб",
пожалуйста, восстановите свой пароль самостоятельно, либо свяжитесь с администратором через Телеграм.
Вы используете устаревший браузер. Этот и другие сайты могут отображаться в нём некорректно.
Вам необходимо обновить браузер или попробовать использовать другой.
Вам необходимо обновить браузер или попробовать использовать другой.
Помощь с д/з
- Автор темы Whisper*
- Дата начала
A
angelolenka
Гость
FeCl3+3NaOH=Fe(OH)3+3NaCl
найдем, какое вещество находится в избытке, какое в недостатке:
162,5г/моль (FeCl3) - 40г/моль (NaOH)
х моль (FeCl3) - 0,24 моль (NaOH)
x=0,975моль FeCl3 - дан в недостатке, значит решать будем по FeCl3
M=m/n
m (FeCl3)=M(FeCl3)*n= 162,5*0,2=32,5г
162,5 г/моль - 107г/моль
32,5 г - х г
х=21,4г
0,975 (FeCl3) - x (Fe(OH)3)
32,5 (FeCl3) - 21,4 (Fe(OH)3)
x=0,642
а ответ в задачнике 0,08 моля Fe(OH)3

найдем, какое вещество находится в избытке, какое в недостатке:
162,5г/моль (FeCl3) - 40г/моль (NaOH)
х моль (FeCl3) - 0,24 моль (NaOH)
x=0,975моль FeCl3 - дан в недостатке, значит решать будем по FeCl3
M=m/n
m (FeCl3)=M(FeCl3)*n= 162,5*0,2=32,5г
162,5 г/моль - 107г/моль
32,5 г - х г
х=21,4г
0,975 (FeCl3) - x (Fe(OH)3)
32,5 (FeCl3) - 21,4 (Fe(OH)3)
x=0,642
а ответ в задачнике 0,08 моля Fe(OH)3

Sunshine
Команда "ГКЧП"
В данном случае, для избытка/недостатка молярную массу можно не трогать.
Тогда получается, что J(FeCl3):J(NaOH)=0,2:0,24, а по коэффициентам 1:3, значит в недостатке NaOH.
Исходя из коэффициентов, J(NaOH):J(Fe(OH)3)=3:1, тогда J(Fe(OH)3)=0,24:3=0,08=J(FeCl3, который прореагировал)
Тогда получается, что J(FeCl3):J(NaOH)=0,2:0,24, а по коэффициентам 1:3, значит в недостатке NaOH.
Исходя из коэффициентов, J(NaOH):J(Fe(OH)3)=3:1, тогда J(Fe(OH)3)=0,24:3=0,08=J(FeCl3, который прореагировал)
A
angelolenka
Гость
спасибо огромное! ))
A
angelolenka
Гость
добрый день! Вы не могли бы мне помочь составить уравнение реакции для такой задачи:
для определения содержания NaCl в техническом NaNO3 2,00 г последнего растворили в воде и к полученному раствору добавили в избытке раствор AgNO3. Полученный осадок промыли и высушили. масса остатка оказалась равной 0,287г. Найти массу NaCl, содержащегося в исходном образце.
заранее очень благодарна. ))
для определения содержания NaCl в техническом NaNO3 2,00 г последнего растворили в воде и к полученному раствору добавили в избытке раствор AgNO3. Полученный осадок промыли и высушили. масса остатка оказалась равной 0,287г. Найти массу NaCl, содержащегося в исходном образце.
заранее очень благодарна. ))
I
inspector
Гость
Помогите с уравнениями, пожалуйста.
1)FeSO4+KCNS
2)FeCl3+KCNS после этих уравнений вопрос: с каким ионом железа роданистый калий дает характерную реакцию?
3)В первую пробирку, где FeSO4+KCNS добавить 2 милилитра перекиси водорода и составить электронные формулы для процесса окисления и процесса восстановления.
1)FeSO4+KCNS
2)FeCl3+KCNS после этих уравнений вопрос: с каким ионом железа роданистый калий дает характерную реакцию?
3)В первую пробирку, где FeSO4+KCNS добавить 2 милилитра перекиси водорода и составить электронные формулы для процесса окисления и процесса восстановления.
J
JuLe4kA
Гость
Помогите,пожалуйста с 2-мя задачами:
1)Сколько и какого вещества останется в избытке,если к 75 мл 0,3 н. раствора серной кислоты прибавить 125 мл 0,2 н. раствора калиевой щелочи?
2)Какой объем 0,2 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,51 г гидроксида калия в 30 мл?
1)Сколько и какого вещества останется в избытке,если к 75 мл 0,3 н. раствора серной кислоты прибавить 125 мл 0,2 н. раствора калиевой щелочи?
2)Какой объем 0,2 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,51 г гидроксида калия в 30 мл?
П
Подруга
Гость
Ребята,помогите,пожалуйста,решить хотя бы одну из задач...В пятницу надо сдать. Заранее огромное спасибо!!
Задача 1.
На восстановление 3,6 х 10 в степени (-3) кг.оксида металла
израсходовалось 1,7 х 10 в степени (-3) м (в кубе) водорода (н.у.).
Расчитать эквивалент металла. В ответе должно быть 16.
Задача 2.
Железо находится в контакте с цинком в серной среде. Какой из металлов
будет разрушаться при этих условиях? Ответ мотивировать расчётом ЭДС
процесса корозии и написать уравнение анодного и катодного процессов.
Задача 3.
Какое из перечисленных газообразных водородных соединени наиболее прочно
: NH3, PH3, AsH3, SbH3, BiH3 ? Ответ мотивировать сравнением величин
дэльта G298 этих соединений.
Задача 1.
На восстановление 3,6 х 10 в степени (-3) кг.оксида металла
израсходовалось 1,7 х 10 в степени (-3) м (в кубе) водорода (н.у.).
Расчитать эквивалент металла. В ответе должно быть 16.
Задача 2.
Железо находится в контакте с цинком в серной среде. Какой из металлов
будет разрушаться при этих условиях? Ответ мотивировать расчётом ЭДС
процесса корозии и написать уравнение анодного и катодного процессов.
Задача 3.
Какое из перечисленных газообразных водородных соединени наиболее прочно
: NH3, PH3, AsH3, SbH3, BiH3 ? Ответ мотивировать сравнением величин
дэльта G298 этих соединений.
Крокозябра
Почетный участник
Подруга
Задача 1, я еще поломаю голову. Пока самое простое, что приходит в голову
1) найти число моль водорода
2) найти число моль металла
3) узнать сколько моль металла соединится с 1 моль водорода - это и есть эквивалент металла.
Загвоздка, на сколько понимаю в п.2
Задача 2
Скажу одно, разрушаться (окисляться) будет цинк, как более электроотрицательный элемент.
(-)А: Zn - 2e– = Zn2+
Схема коррозионной гальванопары, примерно такая: (-) Zn | среда | Fe (+).
ЭДС рассчитывается как разность потенциалов катода и анода. Электродные потенциалы вычисляются либо по уравнению Нернста, либо еще проще берутся из справочника.
Задача 3
Применим критерий направленности хим. процесса.
Любой химический процесс идет самопроизвольно в направлении убывания энергии Гиббса.

 критерий самопроизвольного протекания процесса
критерий самопроизвольного протекания процесса
Таким образом
открываем "справочник химика" или "конец учебника" находим значения энтальпий и энтропий в стандартных условиях, ищем энергию Гиббса для каждого из веществ.
Располагаем вещества в ряд по убыванию энергии Гиббса, вещества с наименьшей энергией Гиббса будут наименее прочными, а с наибольшей энергией Гиббса - самыми прочными.
Задача 1, я еще поломаю голову. Пока самое простое, что приходит в голову
1) найти число моль водорода
2) найти число моль металла
3) узнать сколько моль металла соединится с 1 моль водорода - это и есть эквивалент металла.
Загвоздка, на сколько понимаю в п.2
Задача 2
Скажу одно, разрушаться (окисляться) будет цинк, как более электроотрицательный элемент.
(-)А: Zn - 2e– = Zn2+
Схема коррозионной гальванопары, примерно такая: (-) Zn | среда | Fe (+).
ЭДС рассчитывается как разность потенциалов катода и анода. Электродные потенциалы вычисляются либо по уравнению Нернста, либо еще проще берутся из справочника.
Задача 3
Применим критерий направленности хим. процесса.
Любой химический процесс идет самопроизвольно в направлении убывания энергии Гиббса.
Таким образом
открываем "справочник химика" или "конец учебника" находим значения энтальпий и энтропий в стандартных условиях, ищем энергию Гиббса для каждого из веществ.
Располагаем вещества в ряд по убыванию энергии Гиббса, вещества с наименьшей энергией Гиббса будут наименее прочными, а с наибольшей энергией Гиббса - самыми прочными.
Sunshine
Команда "ГКЧП"
Ete написал(а):2.) Реакция D-глюкозы+метанол (в присутствии HCl).
Надо брать таутомерную форму глюкозы?
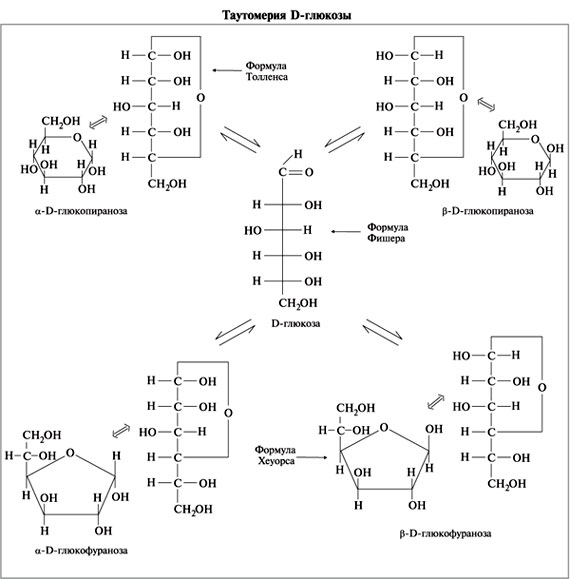
Школьное задание? Если да, то я бы взяла центральную формулу глюкозы, т.е. формулу Фишера.
Sunshine
Команда "ГКЧП"
Ete
В любом случае, таутомерные формы обычно в задании оговариваются.
Что касается первого задания, то хлорангидрид уксусной кислоты выступает в роли ацилирующего агента - это бесспорно. Но что-то мне не верится, что ацилирование пойдёт во всех положениях - нужно посмотреть, что там как с электронной плотностью в каждом случае.
В любом случае, таутомерные формы обычно в задании оговариваются.
Что касается первого задания, то хлорангидрид уксусной кислоты выступает в роли ацилирующего агента - это бесспорно. Но что-то мне не верится, что ацилирование пойдёт во всех положениях - нужно посмотреть, что там как с электронной плотностью в каждом случае.
Ю
Юлёк
Гость
Всем привет!!!! Помогите пожалуйста...Спасибо!!!
Анодное окисление сульфата хрома (III) протекает по уравнению Cr2(SO4)3 + 4H2O + 3/2O2 = H2Cr2O7 + 3H2SO4. Сколько ампер-часов электричества потребуется для получения таким путём 1 кг. дихромовой кислоты при выходе по току 45%. Ответ должен быть 328,0 А-ч.
Анодное окисление сульфата хрома (III) протекает по уравнению Cr2(SO4)3 + 4H2O + 3/2O2 = H2Cr2O7 + 3H2SO4. Сколько ампер-часов электричества потребуется для получения таким путём 1 кг. дихромовой кислоты при выходе по току 45%. Ответ должен быть 328,0 А-ч.
Б
Барби
Гость
Девушки!!Помогите пож!!На завтра срочно надо.Буду благодарна как чебурашка Богу!!!Оч прошу!Задания,которые отмечены галочкой!
F@ncy
Участник
Всем привет!!!
Помогите пожалуйста с такой задачкой:
Смесь веществ, образовавшихся после реакции Al cо смешанным оксидом железа (Fe3O4 - FeO & Fe2O3) обработали раствором NaOH - выделяется 1.344 л газа. При обработке соляной кислотой выделяется 5.376 л газа. Определить состав смеси (в массовых долях).
Я запуталась с самого начала- какие уравнения получаются, и сколько их вообще -2 или 6?..
Помогите пожалуйста с такой задачкой:
Смесь веществ, образовавшихся после реакции Al cо смешанным оксидом железа (Fe3O4 - FeO & Fe2O3) обработали раствором NaOH - выделяется 1.344 л газа. При обработке соляной кислотой выделяется 5.376 л газа. Определить состав смеси (в массовых долях).
Я запуталась с самого начала- какие уравнения получаются, и сколько их вообще -2 или 6?..

Sunshine
Команда "ГКЧП"
Давайте по порядку разбирать.F@ncy написал(а):Смесь веществ, образовавшихся после реакции Al cо смешанным оксидом железа (Fe3O4 - FeO & Fe2O3) обработали раствором NaOH - выделяется 1.34 л газа. При обработке соляной кислотой выделяется 5.376 л газа. Определить состав смеси (в массовых долях).
1. Реакция алюминия с оксидом железа.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
По идее, если написать реакции отдельно для оксидов двух- и трёхвалентного железа, получится то же самое. Задумалась было о переходности алюминия, но не думаю, что она здесь к месту.
2. Смесь обработали NaOH. Железо с щёлочью взаимодействовать не может, а вот оксид алюминия - запросто.
Al2O3 + 2 NaOH = H2O + 2 NaAlO2 (это сплавление)
2NaOH + Al2O3 + 3H2O = 2Na[Al(OH)4] (это уже раствор, но нам нужно выделение газа)
6NaOH + Al2O3 + 6H2O = 2Na3[Al(OH)6] + 3H2 (где водород - как раз выделяющийся газ)
3. Ту же смесь обработали HCl
6HCl + Al2O3 = 2AlCl3 + 3H2O
2HCl + Fe = FeCl2 + H2 (образуется именно соль двухвалентного железа, до трёхвалентного состояния оно окисляется только галогенами, азотной и концентрированной серной кислотами)
Итого для рассчётов нам нужны 3 реакции.
Какие ещё вопросы по задаче?
F@ncy
Участник
Ой, спасибо огромное!!! Я вот такие уравнения писать не умею(со скобками квадратными...)
Я вот такие уравнения писать не умею(со скобками квадратными...)
А так все получается легко - из реакции с NaOH находится масса Al2O3, а из реакции с HCl - железа. Получилось 17% и 83%
Еще только хотела спросить, почему железо с щелочью не реагирует - т.к. оно правее натрия?
 Я вот такие уравнения писать не умею(со скобками квадратными...)
Я вот такие уравнения писать не умею(со скобками квадратными...)А так все получается легко - из реакции с NaOH находится масса Al2O3, а из реакции с HCl - железа. Получилось 17% и 83%

Еще только хотела спросить, почему железо с щелочью не реагирует - т.к. оно правее натрия?
Sunshine
Команда "ГКЧП"
только нужно учесть, что газ выделяется и при реакции с оксидом алюминия, т.е. сначала, зная количество оксида алюминия, нужно узнать, сколько газа выделяется именно в реакции с железомF@ncy написал(а):а из реакции с HCl - железа.
Всё проще: щёлочи реагируют с кислотами (реакция нейтрализации), с кислотными и амфотерными оксидами + реакция разложения нерастворимых оснований.F@ncy написал(а):Еще только хотела спросить, почему железо с щелочью не реагирует - т.к. оно правее натрия?
Такие уравнения объясняют, когда проходят комплексные соединения, до этого их, увы, приходится просто заучивать.F@ncy написал(а):Я вот такие уравнения писать не умею(со скобками квадратными...)
F@ncy
Участник
Ну вот, я не понялаSunshine написал(а):только нужно учесть, что газ выделяется и при реакции с оксидом алюминия т.е. сначала, зная количество оксида алюминия, нужно узнать, сколько газа выделяется именно в реакции с железом

Я так посчитала:
6NaOH + Al2O3 + 6H2O = 2Na3[Al(OH)6] + 3H2
тут m(Al2O3)=1.344*102/67.2=2.743
2HCl + Fe = FeCl2 + H2
тут m(Fe)=56*5.376/22.4=13.44
Потом сложила их массу и нашла в %..

Понятно, надо усиленно учить неорганику, а то меня на олимпиаду отправят скороSunshine написал(а):Такие уравнения объясняют, когда проходят комплексные соединения, до этого их, увы, приходится просто заучивать.

Похожие темы
- Ответы
- 6
- Просмотры
- 5K

