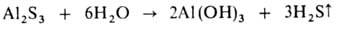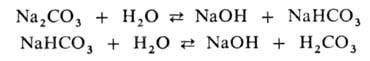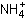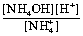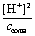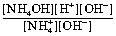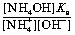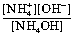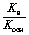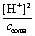Verunja
Жёлто-коричневый газ с резким запахом - это Cl2O, гемиоксид, но ему тут взяться неоткуда.
Однако NO2 так же является жёлто-коричневым газом, который оказывает сильное раздражающее действие на слизистые оболочки, т.к. переходит в азотную и азотистую кислоты.
Осталось понять, как именно там образуется этот газ...
svetal
svetal написал(а):
C3H8--C3H7Br--C3H7OH--C2H5COH--C2H5COOH--C2H4-COOH--NH3-C2H4-COOHCHCI NH2
Первая реакция - обыкновенное бромирование под действием кванта света.
Вторая реакция с щелочью в водной среде.
Третья реакция - окисление первичного спирта до альдегида
Четвёртая реакция - окисление
Дальше я, честно говоря, потеряла мысль, что и во что должно превратиться?
svetal написал(а):
Задача-Сколько г хлоридметиламмония можно получить при взаимодействии 160 г метиламина,содержащего 40% примесей с соляной кислотой.
В чём трудность?
CH3NH2 + HCl = [CH3NH3]Cl
То, что метиламин содержит 40% примесей, означает, что в реакции участвует 160 - 160*0,4 = 96 грамм метиламина. Далее это самая обычная задача на пропорцию - см. типовые задачи, задача под номером 1.
inspector
Непонятно что-то конкретное?
inspector написал(а):
1)Гидролиз Ацетата свинца (II) - 2 ступени
2)Гидролиз Нитрата свинца (II) - 2 ступени
3)Можно ли с помощью рН-метра отличить водный раствор хлорида калия от водного раствора хлорида аммония? Ответ обоснуйте
4)рН водного раствора хлорида аммония равен 5.Составьте уравнение реакции гидролиза и рассчитайте исходную концентрацию раствора.
Что есть гидролиз знаем?
ГИДРОЛИЗ (от греч. hydor-вода и lysis - разложение, распад), обменная р-ция между в-вом и водой. При гидролизе солей образуются основания и кислоты. В большинстве случаев это обратимая реакция.
1. Необратимо гидролизуются соли, образованные катионом очень слабого основания и анионом очень слабой кислоты, напр.:
2. Соли, образованные катионом сильного основания и анионом сильной кислоты (напр., LiClO4, NaNO3, KCl), в обычных условиях не гидролизуются и для их водных растворов рН близка к 7.
3. Соли, образованные катионом сильного основания и анионом слабой к-ты (напр., CH3COONa), гидролизуются по аниону.
Благодаря образованию ионов ОН водные растворы таких солей имеют щелочную реакцию (рН > 7). Соли слабых многоосновных кислот гидролизуются ступенчато, причем гидролиз по первой ступени всегда преобладает:
4. Соли, образованные катионом слабого основания и анионом сильной кислоты (напр., АlСl3), гидролизуются по катиону. В реакции участвует только катион, обычно входящий в состав аквакомплекса:
Вследствие образования гидроксоний-ионов водные р-ры таких солей имеют кислую р-цию (рН < 7). Иногда процесс не заканчивается образованием одноядерного аквагидроксокомплекса, а идет дальше с образованием осадка гидроксо- или оксосоли (редко-гидроксида). При комнатной т-ре в большинстве случаев Г. протекает с образованием остающихся в р-ре многоядерных гидроксокомплексов, состав к-рых, как правило, зависит от условий р-ции. Напр., в водных р-рах, содержащих катионы Fe3+, Be2+, Sn2+, образуются комплексы [Fe2(OH)2]4+, [Веэ(ОН)3]3+, [Sn3(OH)4]2+ .
Исходя из этого, первое задание: ацетат свинца - соль образована слабым основанием и слабой кислотой.
Соли, образованные катионом слабого основания и анионом слабой кислоты, например Сu(ООССН3)2, гидролизуются по катиону и по аниону. Pастворы таких солей имеют слабокислую или слабощелочную реакцию в зависимости от того, какой ион гидролизуется в большей степени.
Пример. Гидролиз ацетата алюминия
1. Определяем тип гидролиза:
Al(CH3COO)3 = Al3+ + 3CH3COO–.
Соль образована катионом слабого основания и анионами слабой кислоты. Идет совместный гидролиз.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al3+ + H–OH AlOH2+ + H+,
CH3COO– + H–OH CH3COOH + OH–.
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону. Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3. Составляем молекулярное уравнение:
Al(CH3COO)3 + H2O = AlOH(CH3COO)2 + CH3COOH.
Это тоже формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия.
Второе задание: слабое основание и сильная кислота. Это 4ый случай.
Третье задание: по идее, нет, т.к. обе соли образованы сильными основаниями и сильными кислотами, т.е.в обычных условиях не гидролизуются и значение pH среды близко к нейтральному. Однако не всё так просто для гидролиза хлорида аммония. Реакцию гидролиза хлорида аммония NH4Cl, точнее иона аммония, записывают одним уравнением:
+ Н2О = NH4ОН + Н+.
Образующийся ион водорода обусловливает кислотную среду раствора, т. е. рН < 7.
Несложно рассчитать рН раствора соли известной концентрации.
Четвёртое задание: Исходя из третьего задания, используем формулу для рассчёта константы гидролиза:
Концентрация воды в константу равновесия не входит, т. к. она постоянна.
Преобразовав это выражение, получим константу гидролиза, удобную для расчетов.
Первое преобразование. В соответствии с уравнением реакции концентрации гидроксида аммония и ионов водорода равны: [NH4ОН] = [Н+]. Концентрацию иона аммония можно считать равной концентрации его соли, т. е. [
] = ссоли.
Тогда Кгидр =
=
.