У меня сегодня нестабильно работает Интернет, так что не до красот, в третий раз сабж переписываю
Вообще-то гидроксид меди (II) используется в качественных реакциях, по этому в хороших учебниках вы бы эти реакции нашли бы без труда. У меня учебника нет, так что, посовещавшись с Интернетом, вот что получилось
Все реакции ведутся при нагревании
1) с муравьиной кислотой, думаю, можно записать вот так:
Из карбоновых кислот реакция возможна только для муравьиной кислоты, в следствие наличия альдегидной группы, т.е. кислота ведет себя, как альдегид
HCOOH + 2Cu(OH)2 = CO2 + 3H2O + Cu2O↓
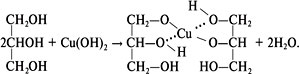
2) Качественная реакция на глицерин – образование ярко-синего глицерата меди(II) при взаимодействии с гидроксидом меди(II):
http://him.1september.ru/article.php?ID=200600505
3) Качественная реакция глюкозы с гидроксидом меди (II)
Глюкоза содержит в своем составе пять гидроксильных групп и одну альдегидную группу. Поэтому она относиться к альдегидоспиртам. Ее химические свойства похожи на свойства многоатомных спиртов и альдегидов. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
http://files.school-collection.edu.ru/dlrstore/ac425a5f-377f-5f58-14f1-2aff690e960c/index.htm