Sunshine
Команда "ГКЧП"
Всем!
Ещё раз повторюсь, указывайте сроки выполнения. И, желательно, для чего нужно задания. Т.к. в школе и в университете задачи решаются на разных уровнях.
Просто в противном случае вы рискуете оказаться без необходимой помощи.
Beznesenok
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Cu + NaOH = реакция не идёт, насколько я помню.
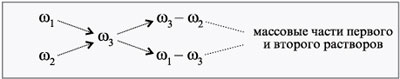
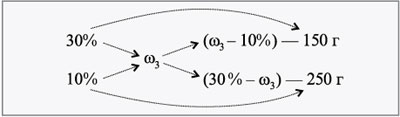
Тогда по первой реакции J(H2) = 5,6/22,4 = 0,25 моль
по коэффициентам J(Al) = 0,25 / 3 * 2 = 0,17 моль
Таким образом, в азотной кислоте растворяется медь.
А вот тут у нас затруднения. Какая азотная кислота дана - концентрированная или разбавленная? Cu(NO3)2 образуется независимо от этого, но коэффициенты будут разные, поэтому уточните условие.
Александр1990
здравствуй ))
по порядку... №4 - это очень просто.
Чем больше гидроксильных групп содержит спирт, тем более сильные кислотные свойства он проявляет. Это связано с сольватацией, которая и определяет устойчивость соединения. Чем устойчивее соединение, тем более сильные кислотные свойства он проявляет. У этанола размер иона больше, поэтомк он хуже сольватируется, чем метанол. Влияние гидроксильных групп на сольватацию связано с их отрицательным индуктивным эффектом, объясняющимся сильной электроотрицательностью кислорода.
Фенол проявляет более сильные кислотные свойства, чем этанол, т.к. кислород ОН-группы входит в сопряжение с бензольным кольцом, а оно оттягивает электронную плотность на себя. Таким образом, заряд ядра более делокализован. Ну и HCl сильнее фенола, т.к. сильный электролит.
№5
Этанол... Получаешь метан (Al4C3 + H2O, если не ошибаюсь), затем прибавляешь к нему хлор (реакция замещения), из CH3Cl синтезом Вюрца (добавление натрия) получаешь этан, его дегидрируешь и гидратируешь.
Либо ацетилен (CaC2+H2O), потом его гидрируешь до этилена и гидратируешь. Последние 2 действия можно и в обратном порядке.
Этиленгликоль. Получаешь этилен (см. выше) и окисляешь его перманганатом калия в водной или слабо щелочной среде.
№6
Этиленгликоль и глицерин реагируют с Cu(OH)2. Красивая такая реакция... Этиленгликолят и глицерат меди, оба синие.
А фенол... Бромная вода даст осадок 2,4,6 трибромфенола.
Задачу тогда пробуй решить сам
Вопросы по вышенаписанному есть?
Ещё раз повторюсь, указывайте сроки выполнения. И, желательно, для чего нужно задания. Т.к. в школе и в университете задачи решаются на разных уровнях.
Просто в противном случае вы рискуете оказаться без необходимой помощи.
Beznesenok
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Cu + NaOH = реакция не идёт, насколько я помню.
Тогда по первой реакции J(H2) = 5,6/22,4 = 0,25 моль
по коэффициентам J(Al) = 0,25 / 3 * 2 = 0,17 моль
Таким образом, в азотной кислоте растворяется медь.
А вот тут у нас затруднения. Какая азотная кислота дана - концентрированная или разбавленная? Cu(NO3)2 образуется независимо от этого, но коэффициенты будут разные, поэтому уточните условие.
Александр1990
здравствуй ))
по порядку... №4 - это очень просто.
Чем больше гидроксильных групп содержит спирт, тем более сильные кислотные свойства он проявляет. Это связано с сольватацией, которая и определяет устойчивость соединения. Чем устойчивее соединение, тем более сильные кислотные свойства он проявляет. У этанола размер иона больше, поэтомк он хуже сольватируется, чем метанол. Влияние гидроксильных групп на сольватацию связано с их отрицательным индуктивным эффектом, объясняющимся сильной электроотрицательностью кислорода.
Фенол проявляет более сильные кислотные свойства, чем этанол, т.к. кислород ОН-группы входит в сопряжение с бензольным кольцом, а оно оттягивает электронную плотность на себя. Таким образом, заряд ядра более делокализован. Ну и HCl сильнее фенола, т.к. сильный электролит.
№5
Этанол... Получаешь метан (Al4C3 + H2O, если не ошибаюсь), затем прибавляешь к нему хлор (реакция замещения), из CH3Cl синтезом Вюрца (добавление натрия) получаешь этан, его дегидрируешь и гидратируешь.
Либо ацетилен (CaC2+H2O), потом его гидрируешь до этилена и гидратируешь. Последние 2 действия можно и в обратном порядке.
Этиленгликоль. Получаешь этилен (см. выше) и окисляешь его перманганатом калия в водной или слабо щелочной среде.
№6
Этиленгликоль и глицерин реагируют с Cu(OH)2. Красивая такая реакция... Этиленгликолят и глицерат меди, оба синие.
А фенол... Бромная вода даст осадок 2,4,6 трибромфенола.
Задачу тогда пробуй решить сам

Вопросы по вышенаписанному есть?

 ((
((