Sunshine
Команда "ГКЧП"
Неорганическая химия
Решение задач с помощью химического уравнения
План решения задач:
1. Записываем "Дано"
2. Составляем уравнения реакций
3. Расставляем коэффициенты
4. Записываем известные данные над уравнением подчёркиваем данные вещества
5. Под формулами подписываем количество вещества (оно соответствует стехиометрическим коэффициентам
6. Находим молярную массу (если дан объём, то подписываем молярный объём (только для газов при н.у.!)), затем находим m=MJ (V=VмJ)
7. Составляем пропорцию, решаем её, записываем ответ.
Пример: Сколько грамм P2O5 образуется, если сгорает 31 грамм фосфора?

Тип 1 Задача на избыток/недостаток
Сколько грамм соли выпадет в осадок, если к 148 г Ca(OH)2 добавили 196 г H3PO4?
По идее, задача решается по пропорции, но возникает вопрос, по какому именно веществу вести расчёт? Для того, чтобы на него ответить находят, какое из двух реагируемых веществ полностью реагирует (т.е. находится в недостатке относительно другого). Для этого используют формулу n = m/(M*k), где k - стехиометрический коэффициент.

Примечание 1
Не буду выделять в отдельный тип, но:
Масса конечного раствора равна сумме масс сливаемых растворов минус масса веществ, которые уходят из раствора (в виде газа или осадка)
Тип 2 Задача на выход продукта
Греческая буква этта обозначает выход продукта в процентах от теоретически возможного. Дело в том, что количество продукта, вычисленное по реакции (масса или объём теоретические) всегда меньше количества, полученного на практике (масса или объём практические), поэтому выход продукта всегда меньше 100% (или 1, если он записано в долях от единицы).
Гидроксидом натрия, взятом в необходимом количестве, подействовали на азотную кислоту. Найдите массу нитрата натрия, если его выход составляет 90%.

Тип 3 Задачи на смешивание (закон диагонального смешивания или "правило креста")
Применяется при смешивании растворов разной концентрации (если раствор смешивается с водой, то концентрация равна 0).
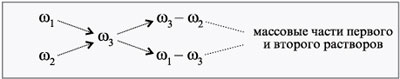
Определите концентрацию раствора, полученного при слиянии 150 г 30%-го и 250 г 10%-го растворов какой-либо соли.
Дано:
m1 = 150 г,
m2 = 250 г,
w1 = 30%,
w2 = 10%.
Найти:
w3.
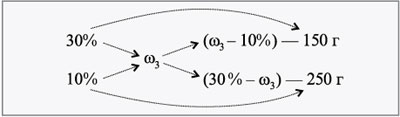
(w3 – 10)/(30 – w3) = 150/250.
Тогда
(30 – w3)•150 = (w3 – 10)•250,
4500 – 150w3 = 250w3 – 2500,
4500 – 2500 = 250w3 – 150w3,
7000 = 400w3, 33 = 7000/400 = 17,5%.
Ответ: при слиянии взятых растворов получится новый раствор с концентрацией w3 = 17,5%.
Тип 4 Задача на наличие примесей
Будет позже.
P.S. Постепенно будет дополняться. Если у вас есть предложения - в приват.
Решение задач с помощью химического уравнения
План решения задач:
1. Записываем "Дано"
2. Составляем уравнения реакций
3. Расставляем коэффициенты
4. Записываем известные данные над уравнением подчёркиваем данные вещества
5. Под формулами подписываем количество вещества (оно соответствует стехиометрическим коэффициентам
6. Находим молярную массу (если дан объём, то подписываем молярный объём (только для газов при н.у.!)), затем находим m=MJ (V=VмJ)
7. Составляем пропорцию, решаем её, записываем ответ.
Пример: Сколько грамм P2O5 образуется, если сгорает 31 грамм фосфора?

Тип 1 Задача на избыток/недостаток
Сколько грамм соли выпадет в осадок, если к 148 г Ca(OH)2 добавили 196 г H3PO4?
По идее, задача решается по пропорции, но возникает вопрос, по какому именно веществу вести расчёт? Для того, чтобы на него ответить находят, какое из двух реагируемых веществ полностью реагирует (т.е. находится в недостатке относительно другого). Для этого используют формулу n = m/(M*k), где k - стехиометрический коэффициент.

Примечание 1
Не буду выделять в отдельный тип, но:
Масса конечного раствора равна сумме масс сливаемых растворов минус масса веществ, которые уходят из раствора (в виде газа или осадка)
Тип 2 Задача на выход продукта
Греческая буква этта обозначает выход продукта в процентах от теоретически возможного. Дело в том, что количество продукта, вычисленное по реакции (масса или объём теоретические) всегда меньше количества, полученного на практике (масса или объём практические), поэтому выход продукта всегда меньше 100% (или 1, если он записано в долях от единицы).
Гидроксидом натрия, взятом в необходимом количестве, подействовали на азотную кислоту. Найдите массу нитрата натрия, если его выход составляет 90%.

Тип 3 Задачи на смешивание (закон диагонального смешивания или "правило креста")
Применяется при смешивании растворов разной концентрации (если раствор смешивается с водой, то концентрация равна 0).

Определите концентрацию раствора, полученного при слиянии 150 г 30%-го и 250 г 10%-го растворов какой-либо соли.
Дано:
m1 = 150 г,
m2 = 250 г,
w1 = 30%,
w2 = 10%.
Найти:
w3.

(w3 – 10)/(30 – w3) = 150/250.
Тогда
(30 – w3)•150 = (w3 – 10)•250,
4500 – 150w3 = 250w3 – 2500,
4500 – 2500 = 250w3 – 150w3,
7000 = 400w3, 33 = 7000/400 = 17,5%.
Ответ: при слиянии взятых растворов получится новый раствор с концентрацией w3 = 17,5%.
Тип 4 Задача на наличие примесей
Будет позже.
P.S. Постепенно будет дополняться. Если у вас есть предложения - в приват.
